دانشمندان نحوه عملکرد پروتئین های اصلی درگیر در سرطان و بیماری آلزایمر را تعیین کرده اند
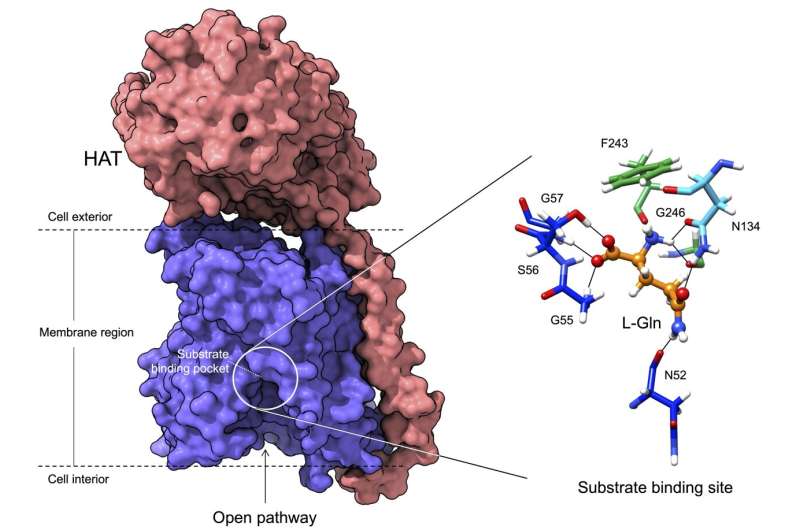
پروتئین هایی که به خانواده HAT تعلق دارند برای زندگی ضروری هستند زیرا اسیدهای آمینه را در غشای سلولی انتقال می دهند. اگرچه اعضای این خانواده تقریباً یکسان هستند، اما برخی از آنها اسیدهای آمینه خاصی را منتقل می کنند و برخی دیگر را منتقل نمی کنند. این تخصص نقش آنها را در عملکردهای خاص مانند رشد سلولی یا عملکردهای عصبی و در نتیجه در بیماری های مرتبط مانند سرطان یا بیماری های عصبی مانند بیماری آلزایمر تعیین می کند. چه چیزی این ویژگی و تنوع ویژگی ها را می دهد؟ این یکی از سوالاتی است که توسط محققان مرکز ملی تحقیقات سرطان اسپانیا (CNIO) و موسسه تحقیقات بیومدیکال (IRB Barcelona) که رهبری این مطالعه را بر عهده دارند، پرسیده اند و پاسخ آنها این هفته در مجله منتشر شده است. اطلاعیه های آکادمی ملی علوم (PNAS).
به لطف آخرین فناوریهای ساختاری با وضوح بالا مانند میکروسکوپ کرایوالکترونی، همراه با مدلسازی محاسباتی و طراحی جهشیافتههای این پروتئینها، محققان توانستند ساختار یکی از اعضای این خانواده از پروتئینها را با جزئیات اتمی مشاهده کنند و عملکرد آن را رمزگشایی کنند. نتایج این مطالعه نشان میدهد که چگونه تنها تعداد کمی از باقیماندهها - واقع در مناطق خاصی - از این خانواده از پروتئینها، اسیدهای آمینه خاصی را انتخاب میکنند که به آنها متصل میشوند و بنابراین مسئول مشارکت پروتئین در عملکردهای فیزیولوژیکی خاص هستند.
محققان با داشتن این اطلاعات، اکنون با چالش یافتن درمانها و ابزارهای تشخیصی جدید برای بیماریهایی که شامل خانواده پروتئینهای حملونقل HAT میشوند، با علاقه خاصی به شرایطی که مشکلات سلامتی جدی مانند سرطان و اختلالات تخریبکننده عصبی را ایجاد میکنند، روبرو هستند. بیماری آلزایمر.
درک چگونگی اختلال در عملکرد آنها
آمینو اسیدها، بلوک های ساختمانی اساسی زندگی، وارد سلول ها و خارج می شوند و به آنها اجازه رشد، تقسیم و توسعه عملکردهایشان را می دهند. این حرکت در داخل و خارج سلول به دلیل دروازه های تعبیه شده در غشای سلولی است که توسط پروتئین هایی از خانواده HAT و غیره تشکیل شده است.
اگرچه پروتئینهای HAT از نظر ساختار تقریباً یکسان هستند، برخی از آنها اسیدهای آمینه خاصی را منتقل میکنند و برخی دیگر را منتقل نمیکنند، بنابراین برای هر یک از اعضای خانواده عملکردهای خاصی مانند مشارکت در رشد سلولی را فراهم میکنند. نقش در بیماری هایی مانند سرطان؛ عملکردهای عصبی؛ و انتقال مواد سمی و مشارکت در اعتیاد به موادی مانند کوکائین.
برای درک این ویژگی عملکرد، دانشمندان شروع به مطالعه ساختار سه بعدی این خانواده مهم از پروتئین ها کردند. اسکار لورکا، رئیس مجتمعهای ماکرومولکولی، میگوید: «تکنیکهای کلاسیکی که برای تعیین ساختار پروتئینها استفاده میشوند، مانند تکنیکهایی که از اشعه ایکس استفاده میکنند، با پروتئینهای جاسازی شده در غشاهای بیولوژیکی موفقیت محدودی داشتهاند و بسیاری از مسائل حلنشده باقی ماندهاند». در گروه پاسخ به آسیب DNA در CNIO، مدیر برنامه زیست شناسی ساختاری مرکز و یکی از نویسندگان مقاله. "به ما امکان می دهد تا عملکرد ناقل آمینو اسیدها را رمزگشایی کنیم. در این مورد، ما از این فناوری برای شناسایی مکانیسم های مولکولی استفاده کردیم. مانوئل پالاسین، رئیس آزمایشگاه اسیدها و بیماریهای آمینه در IRB بارسلونا، پروفسور دانشگاه بارسلونا و رئیس CIBERER میگوید: «این پروتئینها را برای انتقال برخی از اسیدهای آمینه هدایت میکند، اما برخی دیگر را نه.
داروهای جدید علیه سرطان و بیماری آلزایمر
به لطف میکروسکوپ کرایوالکترونی، منطقهای که لورکا در آن متخصص بینالمللی است، تجسم ساختار مولکولی پروتئینها گامی عظیم به سوی آنچه اکنون به عنوان عصر طلایی ساختارهای سهبعدی میشناسیم، برداشته است. این فناوری جدید که برنده جایزه نوبل شیمی در سال 2017 شد، نه تنها به نظارت بر فرآیندهای بیولوژیکی مانند قبل عمل می کند، بلکه به سرعت بخشیدن به توسعه ترکیبات جدید و داروهای مورد علاقه برای درمان سرطان و سایر بیماری های انسانی کمک می کند. .
در این کار، با استفاده از میکروسکوپ الکترونی کرایو، محققان توانستند ساختار یکی از اعضای خانواده HAT را با وضوح اتمی تجسم کنند و محل اتصال این پروتئینها به اسیدهای آمینه و همچنین جزئیات مکانیسمی را که توسط آن به اسیدهای آمینه متصل میشوند را تعیین کنند. این اتفاق می افتد.
جزئیات اتمی نشان میدهد که تنها تعداد کمی از این پروتئینها اسیدهای آمینهای را که به آنها متصل میشوند و در نتیجه عملکردهای خاص آنها را تعیین میکنند. علاوه بر این، این مطالعه نشان میدهد که چگونه جایگزینی برخی از باقیماندهها با برخی دیگر در این موقعیتها در اعضای مختلف خانواده، مسئول تغییر ویژگی تشخیص و انتقال برخی از اسیدهای آمینه است و نه دیگران.
نتایج این مطالعه میتواند منجر به ترکیباتی شود که بر روی نواحی خاصی از این پروتئینها اثر میگذارند و اختلالاتی را که در آن نقش دارند، مانند سرطان و بیماریهای تخریبکننده عصبی مانند بیماری آلزایمر، کنترل میکنند.
نقل قول: دانشمندان نحوه عملکرد پروتئین های اصلی درگیر در سرطان و بیماری آلزایمر را تعیین می کنند (2021، 29 نوامبر)، استخراج شده در 29 نوامبر 2021 از https://phys.org/news/2021-11-scientists- mode-action -essential-proteins .html
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به جز هرگونه معامله منصفانه به منظور مطالعه یا تحقیق خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوا فقط برای مقاصد اطلاعاتی ارائه شده است.
[ad_2]
