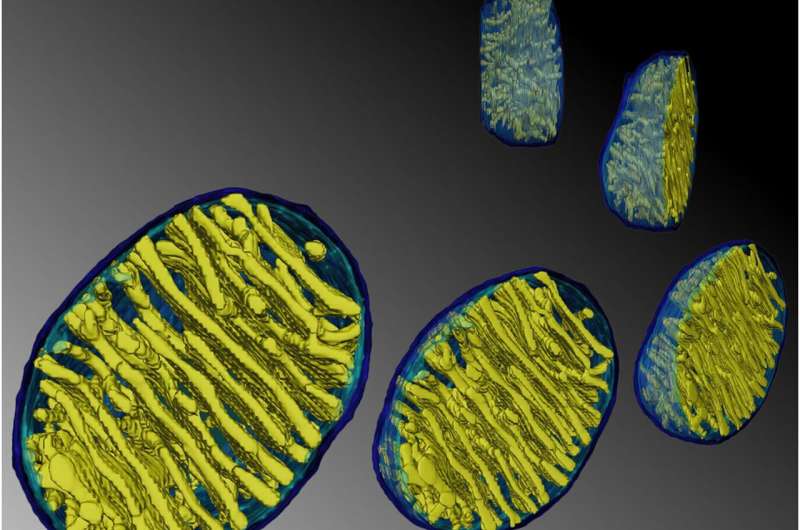
یکی از بزرگترین چالشهای زیستشناسی امروزه توضیح ساختار کریستا، غشای داخلی میتوکندری است. توضیح در این مورد مجموعه ای از اصول برای پیش بینی شکل کریستا پس از دستکاری های متابولیکی عمده در محیط میتوکندری است. بنابراین، این اصول توصیفی از عملکرد واقعی میتوکندری خواهد بود، چیزی که تاکنون به سختی تصور شده است.
پیشرفتهای اخیر در تکنیکهایی مانند میکروسکوپ نوری با وضوح بالا سلولهای زنده و توموگرافی الکترونی دیدگاه جدیدی به رفتار دینامیکی کریستاها داده است. اکنون می توان یک معماری دقیق از کل حجم میتوکندری را از مجموعه ای از تصاویر مایل ایجاد کرد که برای ایجاد توموگرام های سه بعدی به عقب بازتاب می شوند. روز دوشنبه، در مورد چگونگی تبدیل و پیکربندی کریستاها با توجه به فراوانی و سلامت چندین پروتئین غشای داخلی و ماتریکس بحث کردیم. دلیل این تجزیه و تحلیل شباهتهای ساختاری و بیوشیمیایی بین غشاهای میتوکندری، تیلاکوئیدها و میلین بود که احتمالاً به هدایت متابولیتها در تولید انرژی کمک میکند.
در مقاله اخیر انجمن سلطنتی زیست شناسی بازمحققان بیوژنز کریستا را از طریق فعالیت های هماهنگ در چهار مسیر اصلی که از پروتیست ها و مخمرها به یوکاریوت های بالاتری مانند ما تکامل یافته اند توضیح می دهند: تشکیل دایمر و الیگومریزاسیون سنتاز ATP در لبه کریستاها، مونتاژ محل تماس میتوکندری و سیستم برای سازمان. کریستا (MICOS) در اتصالات کریستا، بازسازی غشاء توسط GTPase متصل به غشاء داخلی، متصل به دینامین (Mgm1 در مخمر و OPA1 در پستانداران) و تنظیم مناسب ترکیب چربی غشا.
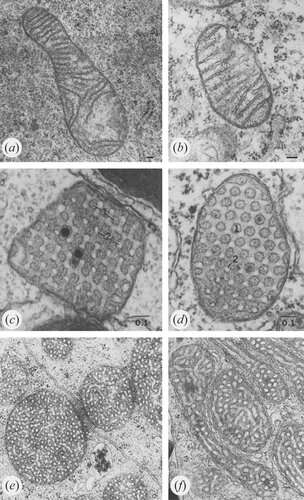
برای اولین بار در مورد ATP سنتاز، چندین چیز واضح است. همانطور که قبلاً گزارش شد، دیمر شدن خود به خودی ATP سنتاز در زوایای کاملاً تعریف شده و وابسته به گونه در ردیفهای مرتب، هندسه طبقه همکف را دیکته میکند. برخلاف کمپلکس های تنفسی I-IV که روی غشای مرز داخلی مسطح جمع شده اند، ATP سنتاز (کمپلکس V) به طور کامل در اعماق غشای کریستا جمع شده است. در حالی که چندین پروتئین زیر واحد ATP-سینتاز برای تشکیل کریستال مناسب مورد نیاز است، زیر واحدهای Atp20 و Atp21 ضروری هستند.
ADP اضافی باعث ترکیب متراکم با فضاهای درون کریستالی بزرگ و متورم می شود. برعکس، تحت شرایط محدود کننده ADP، میتوکندری ها ترکیب ارتدکس را با فضای درون کریستالی منقبض می پذیرند. در آمیب غولپیکر Chaos carolinensis، میتوکندریها معمولاً حاوی کریستاهای لولهای با جهتگیری تصادفی هستند. در طول گرسنگی، کریستای بزرگ شده یک مورفولوژی مکعبی با الگوی زیگزاگی اتخاذ می کند. در موش ها، عوامل آپوپتوز باعث ادغام کریستال های منفرد با آزادسازی بعدی سیتوکروم c از فضای درون کریستالی در ناحیه مرزی می شود.
برای دومین بار، با مونتاژ مکانهای تماس MICOS، تحقیقات نشان داده است که پروتئینهای حیاتی مانند پروتئینهای موجود در خانواده ژنهای مرتبط با MIC60 در پیشسازهای درون همزیستی میتوکندری، α-پروتئوباکتریها وجود دارند. بسیاری از این حاملهای میتوکندری قبلی ساختارهای متمایز غشای داخل سیتوپلاسمی را نشان میدهند. همیشه، گونه هایی که میتوکندری خود را تا حدی ساده کرده اند که کریستا وجود ندارد، ژن های مرتبط با MICOS ندارند. بیان مجدد همولوگهای MIC60 در جهشهای مخمر Δmic60 باعث نجات نقایص فراساختاری میتوکندری میشود.
مسیر سوم شامل GTPaseهای مرتبط با دینامیت است که همجوشی و تقسیم غشاهای داخلی و خارجی را هماهنگ می کند. در طول شکافت، این پروتئین ها به حلقه های انقباضی پلیمریزه می شوند که نیروهای انقباضی را برای سرکوب میتوکندری اعمال می کنند. اکنون فهمیده شده است که نتیجه به برهمکنش این پروتئین ها بستگی دارد، هم با کمپلکس MICOS و اتصالات کریستا، و هم با سیستم های انتقال غشای داخلی و خارجی که در آنجا تجمع می کنند. اینها شامل مجتمع های انتقال غشاء TIM و TOM است.
مسیر چهارم شامل خود فسفولیپیدها بر روی غشای میتوکندری می شود. میتوکندری ها حاوی مسیر بیوسنتزی کاردیولیپین هستند و همچنین در سنتز فسفاتیدیل اتانول آمین نقش دارند. همراه با فسفاتیدیل کولین، اینها سه فسفولیپید اصلی هستند که میتوکندری ها با آنها کار می کنند. بیشتر بلوکهای سازنده لیپیدهای میتوکندری در ER سنتز میشوند و بنابراین باید با مکانیسمهایی وارد شوند که شامل پایبندی نزدیک به ER است. هنگامی که داخل غشای خارجی قرار می گیرد، توزیع لیپید توسط پروتئین های حمل و نقل موضعی بین غشایی از خانواده Ups / PRELI انجام می شود.
میتوکندری ها هندسه را از ابتدا ایجاد نمی کنند، بلکه بیشتر از اشکال فیزیکی طبیعی که به طور خود به خود در لیپیدها به وجود می آیند، استفاده می کنند و بر روی آنها ساخته می شوند. لیپیدها به تنهایی ساختارهای لایهای متحدالمرکزی را تشکیل میدهند که میتوانند توسط پروتئینهای خاص منبسط و تقویت شوند. اندازهگیریهای در مقیاس ظریف قبلاً نشان دادهاند که کریستاهای منفرد از نظر عملکردی مستقل هستند و میتوانند پتانسیلهای غشایی متفاوتی داشته باشند.
تشکیل کریستال شامل یک تعامل نزدیک از چهار تأثیر شکل دهی فوق است. به عنوان مثال، فعالیت های مجتمع MICOS و دیمریزاسیون سنتاز ATP هم همکاری و هم متضاد هستند. MICOS باعث ایجاد انحنای منفی غشاء می شود، در حالی که ATP سنتاز باعث ایجاد انحنای مثبت در نوک و لبه های کریستا می شود. مدلهای محاسباتی جدید، که در حال حاضر در آزمایشگاههای سرتاسر جهان در حال توسعه هستند و میتوان نسبتهای این اجزای مختلف را بهخوبی تنظیم و تنظیم کرد، کمک قابلتوجهی در تعیین اینکه چه چیزی شکل میتوکندری را کنترل میکند، خواهد کرد.
© 2022 Science X Network
نقل قول: چرا میتوکندری ها این شکلی هستند؟ (2022، 19 ژانویه) در 19 ژانویه 2022 از https://phys.org/news/2022-01-mitochondria.html بازیابی شده است.
این برگه یا سند یا نوشته تحت پوشش قانون کپی رایت است. به جز هرگونه معامله منصفانه به منظور تحقیق یا مطالعه خصوصی، هیچ بخشی بدون اجازه کتبی قابل تکثیر نیست. محتوا فقط برای مقاصد اطلاعاتی ارائه شده است.
[ad_2]
مقالات مشابه
- Floyd Mayweather partied در شلوغ آریزونا کلوپ شبانه با ماسک در چشم
- جکسون میزبان مغلوب ساختن پیشی جستن کنوانسیون ملی حزب جمهوری خواه سخنرانی
- اورین هچ: من کمک کرد تا با تصویب قانون آمریکایی های معلول. آینده آن نامشخص است.
- موسیقی، رقص و هنر چگونه می توانند به بهبود آلودگی هوا کمک کنند؟
- شرکت صادرات و واردات کالاهای مختلف از جمله کاشی و سرامیک و ارائه دهنده خدمات ترانزیت و بارگیری دریایی و ریلی و ترخیص کالا برای کشورهای مختلف از جمله روسیه و کشورهای حوزه cis و سایر نقاط جهان - بازرگانی علی قانعی
- انواع کربن فعال | تجهیز یار
- Olivia Culpo بازگشت به لا با مسیحی McCaffrey عجیب و غریب می شود
- غذای بیرون به معنای واقعی کلمه
- ترفند های زندگی و خانه داری - ترفند های زندگی هوشمندانه
- رنجرز حقیقی حذفی سفر خواهد بود مانند یک "پرش بر روی یک قطار در حال حرکت'